星标“医工学人”,第一时间获取医工交叉领域新闻动态~


前言
/
抗体-药物偶联物已成为一种强有力的工具,可提供高度靶向性的癌症疗法。下一代抗体-药物偶联物设计旨在进一步突破极限。
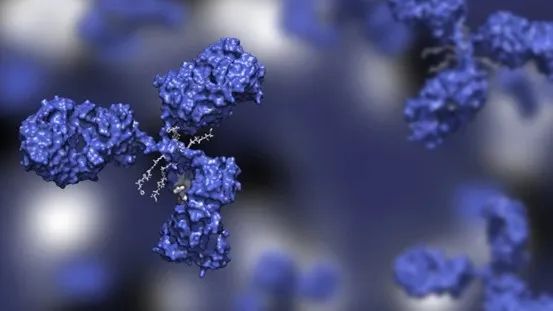
抗体-药物偶联物是一种混合结构,由三个主要成分组成:抗体骨架、细胞毒性有效载荷和结合它们的连接体。图片来源:Huen Structure Bio/Shutterstock.com。
设计新一代ADCs
▼参考资料
https://www.nature.com/articles/d42473-024-00099-y
*本文仅分享医疗科技前沿进展,不代表平台利益。如涉及版权问题,请联系我们删除。
END
编译 | 李升伟
排版 | 徐嘉阳
来源 | Nature
审核 | 医工学人
关注“医工交叉前沿技术”,可进入医工学人交流群

群主微信(申请时请备注个人信息)
点击关注医工学人

本篇文章来源于微信公众号: 医工学人