星标“医工学人”,第一时间获取医工交叉领域新闻动态~


前言
/

5月6日,《自然·生物医学工程》在线发表了帝国理工学院生物工程系最新成果,报道了他们在心肌超声定位显微镜方面的研究成果。
关键要点
1. 有冠心病症状但没有阻塞性冠状动脉的患者存在潜在的微血管疾病,但是仍无法对血管尺寸小且在不断运动的心脏中的微血管结构和血流进行成像。
2. 该研究展示了经胸超声定位显微镜在移植猪心脏和体内患者的心肌微血管系统和血流动力学成像的可行性。
3. 对于心肌功能受损的患者,该技术获得了其屏气期间的心肌血管结构和流量的超分辨图像。
在美国,大约每 34 秒就有一人发生冠状动脉事件——一种由影响冠状动脉的疾病引起的发作,冠状动脉为心肌供血。大约每 83 秒,此类事件就会导致死亡。造成这一死亡人数的主要原因之一是,在药物干预仍可逆转动脉狭窄的情况下,用于检测动脉狭窄的工具性能不佳。如果传统方法使用CT扫描冠状动脉造影,但是它仅能扫描到大的动脉,对于临床关注的有近40% – 50%的疑似冠心病有缺血但伴无阻塞性冠状动脉的患者而言,关注其微血管疾病尤为重要,但目前位置对于微血管结构及血流的成像还未有合适的解决方案。
心肌微血管系统是指心壁内的血管,直径通常为数百微米或更小,对他们成像具有挑战性,不仅因为它们体积小,而且它们在整个心动周期中不断运动。临床 CT、MRI 和核成像方法都缺乏空间分辨率和/或对比度,无法直接可视化这些小血管及其中的血流动力学。最近,尽管超快超声在体外和体内对此类心肌血管进行成像方面显示出前景。然而,血细胞仅能够产生微弱的散射信号,限制了信噪比 (SNR),并且图像分辨率受到经典波衍射极限的限制。
不过,最新的研究克服了这些问题——“他们预示着我们又有新的可以推入任何急症室的机器了!”
这项研究的突破意味着心脏病专家或医生可以快速确定一个人的心肌(心肌)不同区域的状态。作者使用的方法基于超声定位显微镜——一种超分辨率成像技术,借助直径仅为一微米的充满气体的气泡,超越了传统超声成像的分辨率极限。这些微泡被注射到人的血液中,然后在它们穿过用含氧血液灌注心肌的小血管时进行跟踪(图1)。这种技术在心脏中特别有用,因为只有低频信号才能通过低频信号穿透厚厚的肌肉壁,否则空间分辨率非常低。
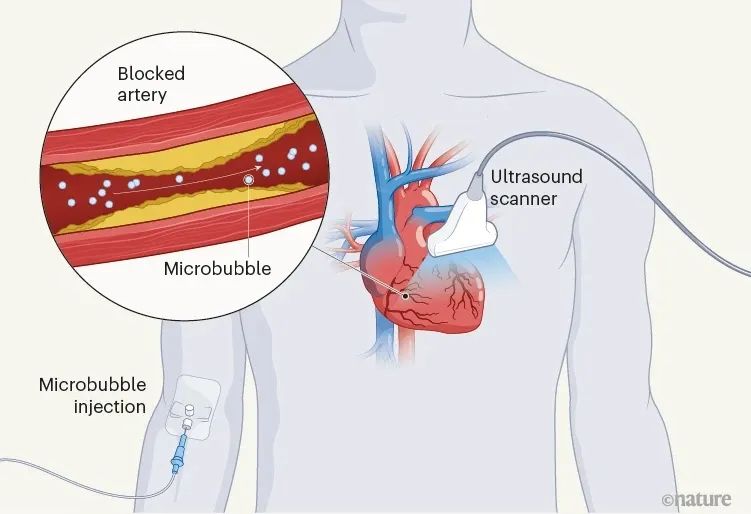
图1 流经心肌的血流的超分辨率成像。该研究表明,超声波可用于通过跟踪充满气体的微气泡通过用含氧血液灌注心肌的小血管的流动来确定人的心肌(心肌)的健康状况。作者开发了一种区分移动结构和静态结构的方法,这提高了该方法的灵敏度,使他们能够在被诊断患有心脏病的人的临床试验中验证其疗效。
虽然超声定位显微镜之前已经报道过,但它在心肌中的应用并不新鲜, Yan 等人现在已经明确显示了它的临床适用性。通过将其用于被诊断患有心脏病的人,并在临床环境中,该团队证实该方法的结果与其他更具侵入性的临床成像方法的结果一致,例如基于CT的冠状动脉造影术。
之前的超声定位显微成像所需的分辨率约为数十微米,且并且必须在心肌在心跳过程中移动和拉伸厘米时进行成像。这可能导致伪影使跟踪小结构极具挑战性,而量化通过它们的血流量则更具挑战性。然而,Yan 等人发现他们能够通过每秒数百张图像跟踪微气泡来规避这些困难,这使得该方法非常灵敏,从而减少了跟踪误差的数量。
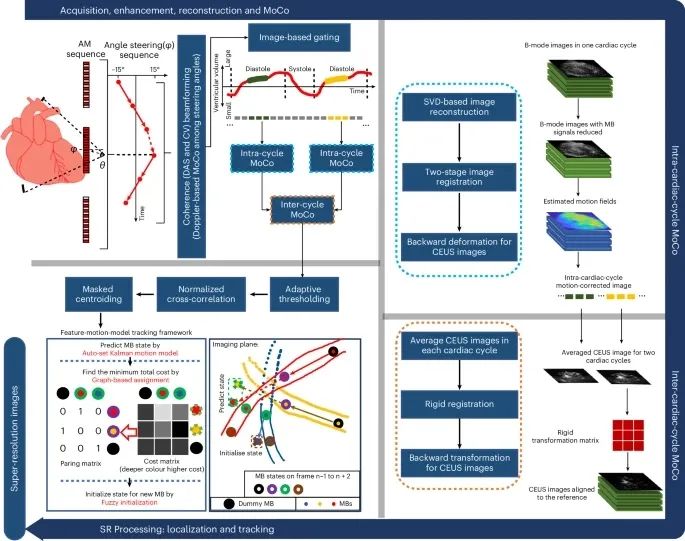
图2 体内数据采集和处理流程 使用三脉冲AM序列检测和分离组织和CEUS信号。发散波以三角形序列以六个角度引导,以进行角度复合。对转向角间的MB运动进行检测和校正,有效增强了角度复合后的对比度信号。使用基于帧强度相关性的门控算法(左上角)排除心动周期舒张期的帧。提出了一种两级,即心内周期(右上)和心脏周期间(右下)的图像配准策略,以纠正复杂的心肌运动。运动校正CEUS图像中的MBs通过归一化互相关进行定位,并通过所提出的特征-运动-模型跟踪框架进行配对。超分辨率 (SR) 图像通过累积 MB 轨迹(左下)绘制。离体数据处理具有相同的管道,没有门控和心循环间运动校正 (MoCo)。可穿戴技术的设计足够灵活,可以随皮肤下喉部肌肉的活动移动并捕捉。
由于使用最传统的心脏超声成像形式,即经胸超声心动图,因此这项工作更具挑战性。经胸超声心动图比临床上使用的其他一些形式的心脏成像更安全,但它也有缺点。也许最大的问题是将探头放置在人的肋骨之间以获得“声学窗口”——一种超声波不受阻碍地穿透心肌的方式。但这会产生伪影,严重影响图像质量,以至于可能需要将超声探头插入人的喉咙。
这些伪影通常是由超声信号从心肌反射,然后从肋骨反弹,然后返回探头造成的。这会产生成像噪声,运动跟踪算法可能会将其误认为是来自心肌的直接反射,从而导致有关底层结构的不准确信息。Yan 等人成功地减少了这些伪影,在受控环境中实现了13-16微米的空间分辨率,在移动的心脏中实现了数百微米的空间分辨率。这一分辨率使作者能够区分跳动的心脏中相距数百微米的血管。他们通过开发将静态结构与移动结构分开的技术来做到这一点,这样错误信号就可以与实际信号(来自移动的微气泡)区分开来。
目前评估通过心肌灌注血液的最先进方法使用正电子发射断层扫描 (PET) 来测量身体处于压力和休息状态时的流速。然而,PET既使人暴露在辐射下,而且在某些国家又非常昂贵。它还需要使用可以合成所用放射性同位素剂的回旋加速器。因此,该技术只能用于设备齐全的医疗中心,而不能用于护理点或急诊室。在这些情况下,超声心动图是最容易获得的方法,因为它成本低、便携性和实时工作能力。
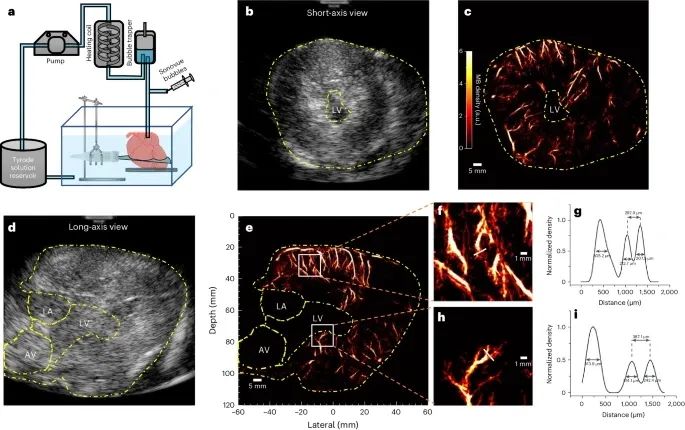
图3 Langendorff离体心脏数据采集和结果(猪) a,用于离体数据集采集的Langendorff设置。b,d, 心脏短轴和长轴视图的B模式图像;黄色虚线描绘了在处理过程中裁剪的区域。c,e, 心肌内微血管系统的相应SR密度图。f,h, e中白盒的放大密度图;白色实线表示容器的切割位置,以便进行横截面分析。g,i, 从截面分析归一化到最大值的密度分布。
现在,由于Yan及其同事的突破,灵敏度可以成为其优势。在临床环境中,超声心动图目前被认为不如 PET 定量,其有效性因操作员而异。仅靠超声并不能提供量化心肌灌注所需的灵敏度,但通过作者的方法,超声定位显微镜现在可以可靠地用于观察心肌中的小血管,绘制其流速并评估心肌的活力。
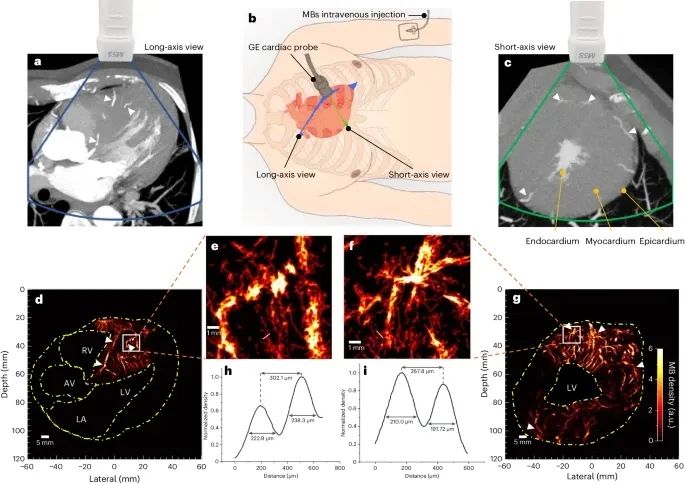
图4 患者1体内计算机断层扫描冠状动脉造影(CTCA)和超声定位显微成像(ULM)a,c,CTCA扫描中的长轴和短轴视图近似于超声扫描中的等效平面。白色箭头表示在两种模式中都可见的相似结构。b,超声探头在胸部用于心脏成像的位置。蓝色和绿色平面分别表示心脏的长轴和短轴视图。d,g, 心肌ULM密度图。黄色虚线表示被裁剪掉的腔室区域。e,f,d和g中白框的放大密度图,白色实线表示容器被切割的位置,以便进行横截面分析。h,i, 从横截面分析归一化到其自身最大值的密度分布。
尽管作者的工作初步证实了该方法的临床可行性,但仍有实际障碍需要克服。例如,每次成像都需要静脉注射微泡,这可能会限制单个人可以执行的次数。对于皮下脂肪含量高的人来说,人工制品的数量也可以增加。该技术目前仅在心肌的被动期(舒张期)有效,而主动期(收缩期)对于评估心脏功能同样重要,甚至更重要。
最后,微气泡含有气体,可能会减弱超声信号的强度,这反过来又可能使更深的心肌区域的成像复杂化。一项涉及多个参与者的更大规模的临床研究可能会解决这些局限性,同时也揭示了该技术的进一步能力。与此同时,Yan及其同事的研究为心肌成像的未来提供了令人兴奋的一瞥。
补充视频:
▼扫描下方二维码阅读全文

*中文报道文章仅供参考,一切以英文原文为准。本文仅分享医疗科技前沿进展,分享内容无任何利益关系。如涉及版权问题,请联系我们删除。
END
编译 | 罗虎
来源 | Nature Biomedical Engineering
审核 | 医工学人
关注“医工交叉前沿技术”,可进入医工学人交流群

小助手微信(申请时请备注个人信息)
推荐阅读
Nature Materials | 机器人神经“袖带”可以帮助治疗一系列神经系统疾病
点击关注医工学人


本篇文章来源于微信公众号: 医工学人