星标“医工学人”,第一时间获取医工交叉领域新闻动态~


在医学领域,慢性伤口(如糖尿病足、静脉性溃疡等)一直是最令人头疼的“沉默负担”。它们恢复缓慢、感染率高、治疗周期长,严重影响患者生活质量,也造成巨大的医疗负担,造成了相当大的经济负担,并深刻影响了患者的生活质量。准确预测伤口愈合状态对于做出明智的决策和根据患者特定需求及时进行个性化干预至关重要,从而有可能缩短恢复时间并改善整体结果。
4月23日,加州理工学院的研究者们在《科学转化医学》发表研究文章,他们设计了一种可穿戴设备 iCares,用于优化缓慢释放的伤口液的收集并感应活性氧和氮物质、pH 值和温度。在糖尿病小鼠中,传感器检测到皮肤伤口感染期间这些因素的变化,并通过抗生素治疗使得它们消退。在 20 名慢性伤口人类患者的队列中,iCares 多参数传感器测量与机器学习算法配对,以对伤口的严重程度和愈合的可能性进行分类。这种原位伤口渗出液分析的进一步发展可以提供对伤口状态的客观评估,为慢性伤口的治疗决策提供信息。——Molly Ogle(编辑总结)
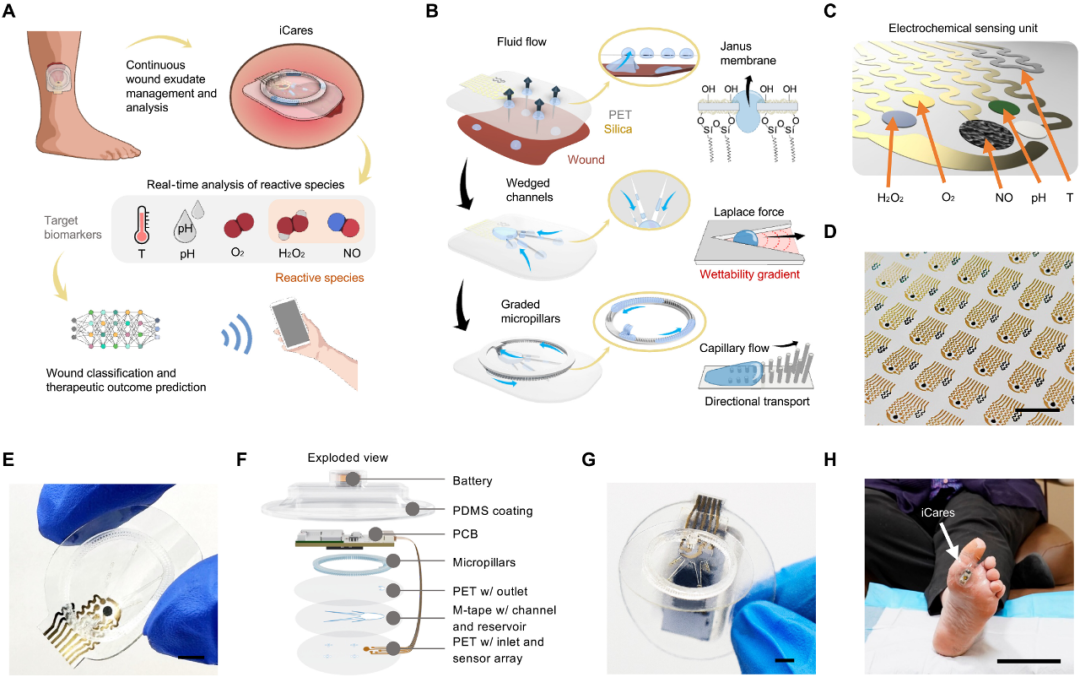
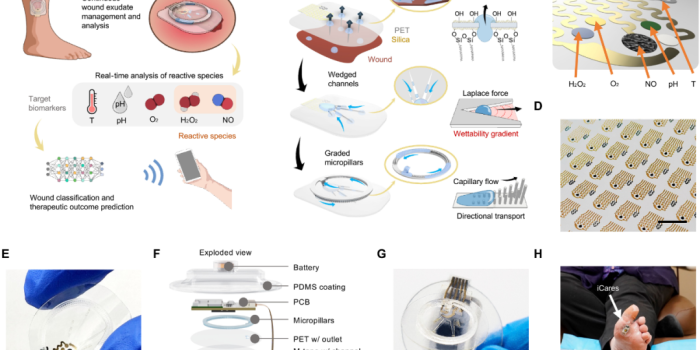
图1 iCares,一种用于伤口渗出液管理、反应性物种分析和个性化伤口评估的无线智能绷带
研究框架:从采样到AI决策的闭环系统
这项研究的最大亮点在于为解决慢性伤口渗出液采集难、分析难、连续监测难的挑战,研究团队提出的集“微流控采集 + 柔性传感 + 无线通信”于一体的iCares智能绷带系统,其结构设计可划分为以下几个核心模块:
图1展示了iCares的完整构成,从外形上看,它是一个贴附于伤口表面的智能创口贴。其核心特征包括:
-
柔性多参数传感器阵列(图1C):可检测NO、H₂O₂、O₂、pH、温度。
-
三层微流控结构(图1B):
-
Janus膜(超疏水/超亲水)促进单向液体流动;
-
楔形通道加速液体吸入;
-
渐变微柱用于流体更新。
-
层叠式封装结构(图1F):
-
从底到顶依次为PET基底、电极层、微流控通道层、感测模块、无线通信PCB、电池、PDMS保护层。
-
无线通信模块(图1G):通过蓝牙实时传输生化数据至移动终端。
-
临床适配能力:兼容Tegaderm等商用医用贴膜,可无创贴附于人体伤口(图1H)。
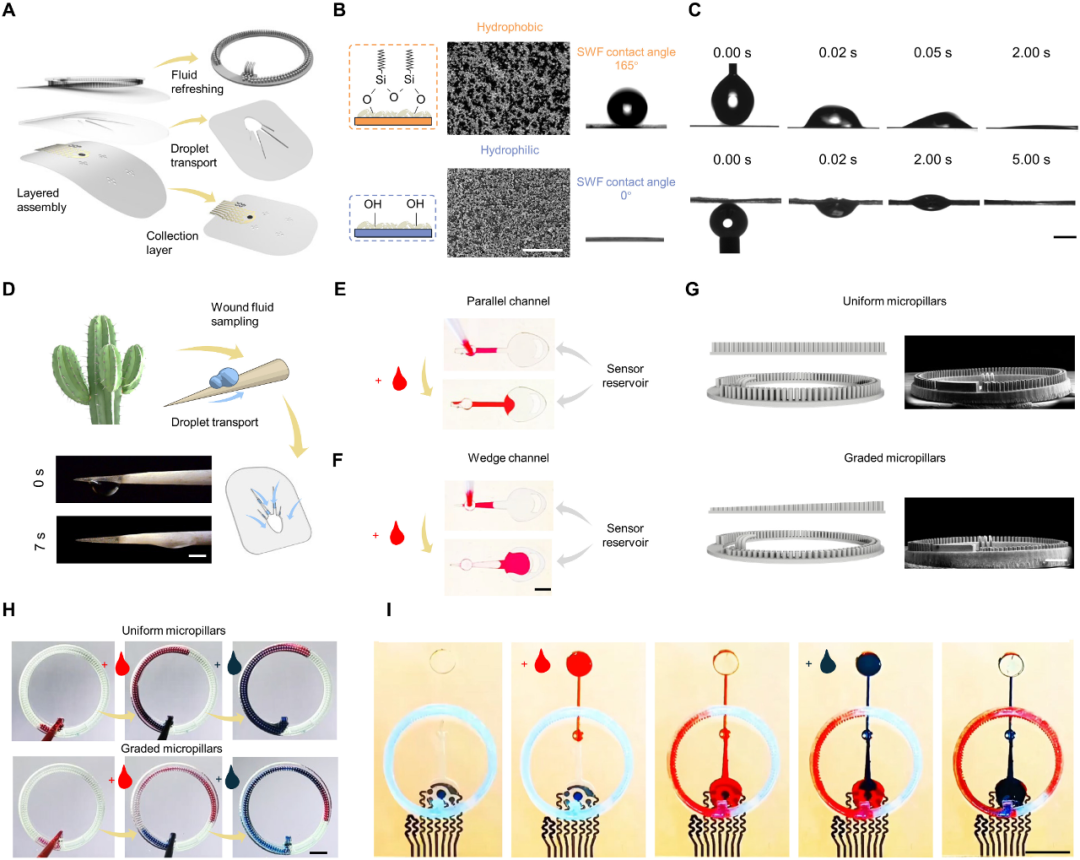
图2 用于高效伤口渗出液管理的 triad 微流体模块的设计和表征
图2集中展示了iCares中最关键的“微流控液体管理系统”,其结构独特之处在于无需泵、电源或外部操作,即可实现:
-
高效采集(Janus膜)
-
图2B/C中展示的Janus膜由涂覆纳米二氧化硅的PET制成,一面超疏水,一面超亲水,利用拉普拉斯压力差形成单向流体通路;
-
膜孔径为100 μm,间距100 μm,支持均匀、快速液体通过。
-
导液传输(楔形通道)
-
图2E/F中对比了楔形与普通通道,借鉴仙人掌刺水收集原理,设计了6°夹角的楔形结构,大大提升了液体传输速率;
-
数值模拟验证了此设计的液体导向优势。
-
液体更新(渐变微柱)
-
图2G/H展示了渐变高度的三维微柱阵列,利用毛细力差异实现液体自动“刷新”;
-
采用红蓝染料实验验证:与均匀微柱相比,渐变结构几乎可消除液体交叉混合,保证时间分辨率。
-
整体自动操作(图2I)
-
在连续液体滴加实验中,前一滴液体(红色)会被“推出”感应区,后一滴液体(蓝色)自动进入,整个过程无需主动控制。
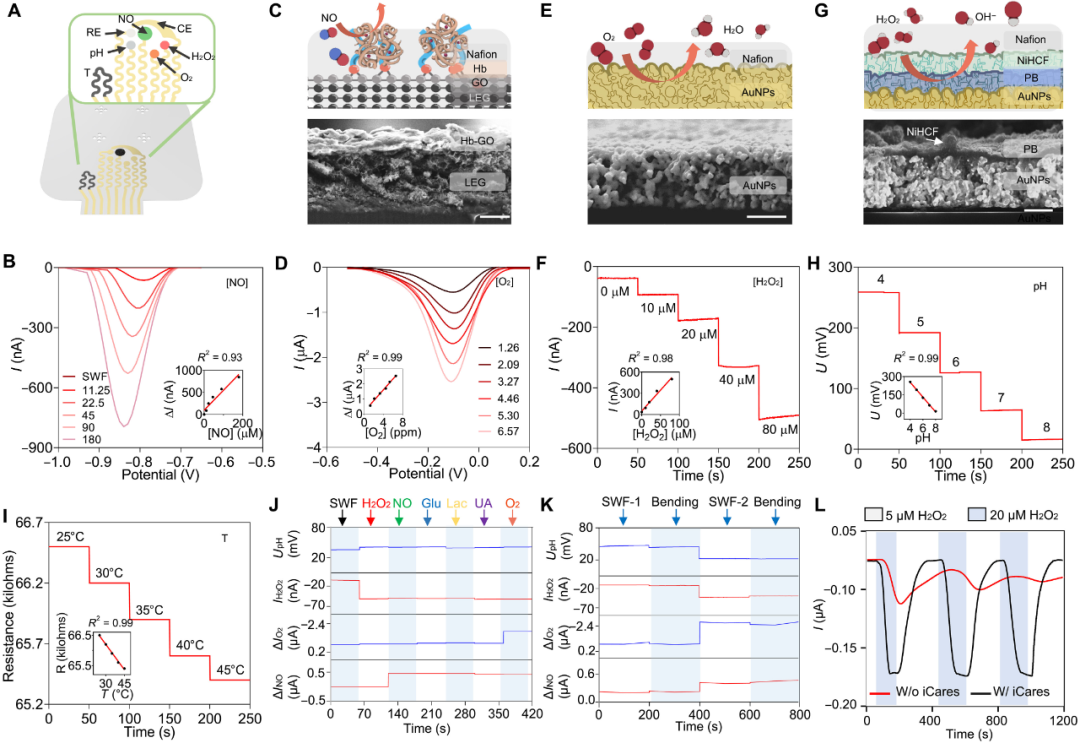
图3 柔性多参数电化学传感器 – 高灵敏,多指标,抗干扰
图3聚焦于传感器阵列的材料、结构与电化学性能优化,核心内容如下:
-
NO传感器(图3B/C)
-
使用激光刻蚀石墨烯(LEG)与石墨烯氧化物(GO)构建电极;
-
血红蛋白(Hb)作为识别分子,能够在−0.8 V下将NO还原为N₂O,从而实现高选择性检测;
-
在模拟伤口液中对NO浓度(0.5–45 μM)呈线性响应,抗干扰能力极强。
-
O₂传感器(图3D/E)
-
采用喷墨打印金纳米颗粒(AuNP)电极,在−0.15 V下检测氧还原;
-
响应范围1.26–6.57 ppm,灵敏度优良。
-
H₂O₂传感器(图3F/G)
-
以普鲁士蓝(PB)/六氰铁镍(NiHCF)双层修饰电极,提高中性pH环境下稳定性;
-
检测限达0.25 μM,灵敏度5.91 nA/μM。
-
pH与温度传感器(图3H/I)
-
pH传感器基于电聚合苯胺(PANI),可在pH 6–8范围内稳定工作;
-
温度传感器基于碳墨阻性变化,支持传感器校准。
-
系统稳定性与多参数协同(图3J–L)
-
设备在机械变形(如50次弯折)后依然保持响应稳定;
-
多参数联合监测显示良好互补性和无明显交叉干扰;
-
微流控系统的存在大幅提升了动态浓度变化响应的准确性与稳定性(图3L)。
通过上述集成设计,iCares不仅仅是一块“高科技绷带”,更是一个可持续运行的“现场实验室”,将复杂的生理信号转化为可被AI解析的数据,为伤口管理提供“感知+决策”新范式。
临床意义:让慢性伤口管理从“经验”迈入“数据时代”
1. 实时监测,早期预警
在小鼠模型中,iCares能在感染临床症状出现前通过H₂O₂等信号检测出伤口异常,实现早干预、早治疗。
2. 人体实验验证,准确预测
在20位慢性伤口患者的临床应用中,AI模型对愈合时间预测的准确率高达94%。对于慢性伤口的个性化治疗与资源优化配置具有重要价值。
3. 适用于资源受限地区
传统伤口管理需频繁前往专科医院,iCares则有望实现居家穿戴、自主监测、远程干预,尤其适用于老龄患者和发展中国家的基层医疗场景。
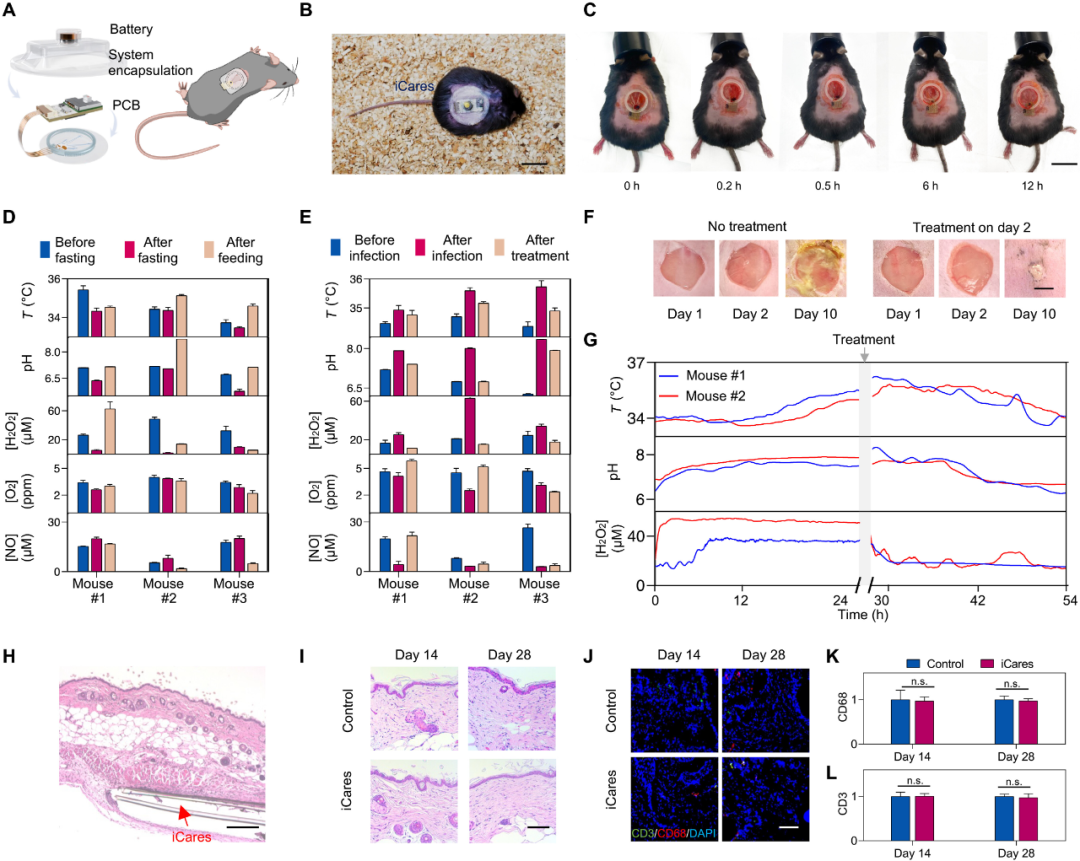
图4 使用糖尿病小鼠模型对 iCares 进行体内评估
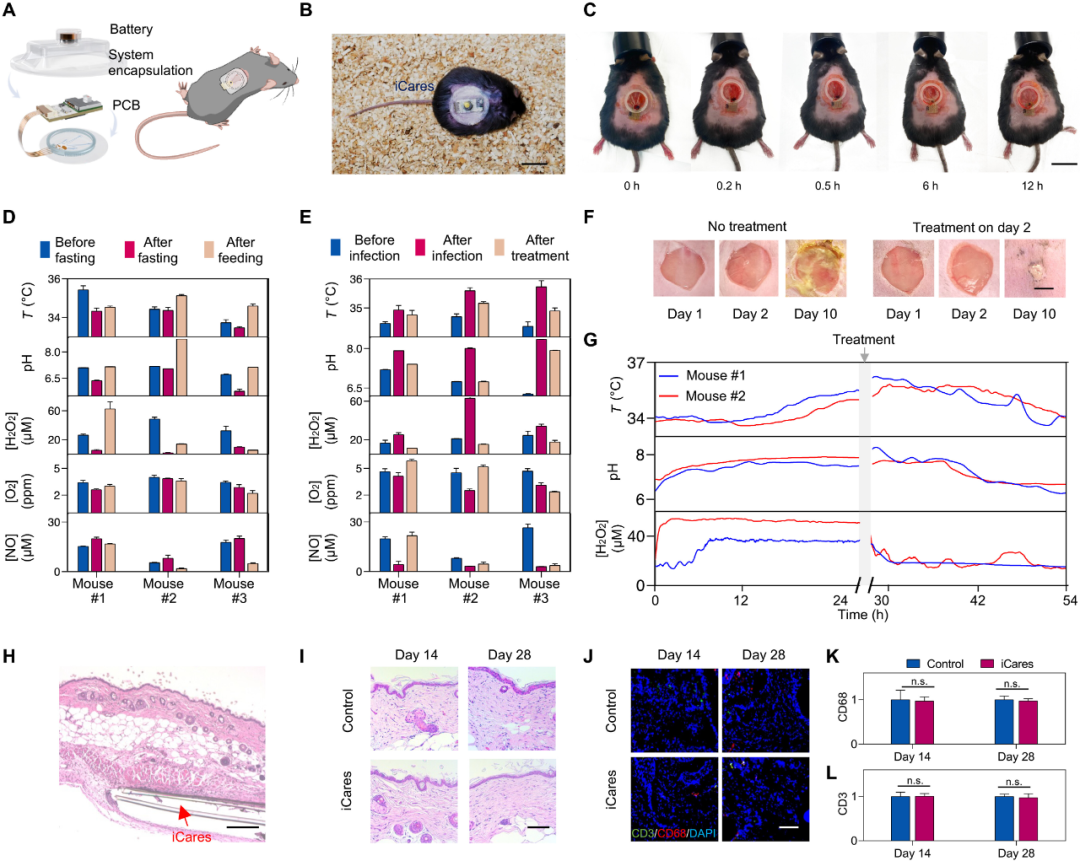
图5 人工智能驱动的 iCares 在慢性伤口患者中的体内评估
科学洞察:从生理过程到治疗反馈的“透明窗口”
iCares的关键优势在于将伤口“不可见”的内在变化变为“可见”的数字信号——
-
NO反映血流重建与免疫调节;
-
H₂O₂是感染与氧化应激的重要信号;
-
O₂含量关系到局部供血与组织代谢。
当这些指标被连续监测并以AI模型处理后,就像为伤口“装上了传感器+大脑”,具备了感知-分析-响应的智能能力。
尽管该研究已经提供了关于伤口渗出物采样、监测和分析的有希望的初步数据。但是,也存在几个限制。第一,尽管 iCare 系统的设计是柔性的,但其固定的形状限制了它适应不同深度、不规则轮廓或愈合过程中动态变化的伤口的能力。第二,可以使用激光切割、喷墨打印和 3D 打印大规模制造 iCare 组件;装配过程需要精确对中和手动作。这种复杂性可能会给大规模生产和一致性带来挑战,从而可能影响可重复性。第三,iCare 系统主要是为监测而设计的,不包括集成治疗模块。
最后,该研究缺乏足够的临床验证,因为伤口状态与伤口渗出液中各种生物标志物之间的相关性仍未完全确定。解决这一差距需要全面的临床试验来验证我们的发现并提高这些生物标志物在不同伤口条件下的预测准确性。通过对不同的患者群体进行广泛的临床试验以验证系统的有效性和可靠性,研究者在文章中写道:预计未来的研究将大大加强慢性伤口管理,提供更精确的数据驱动方法来改善患者护理和治疗结果,同时减轻医疗保健提供者的负担。
Canran Wang et al., A microfluidic wearable device for wound exudate management and analysis in human chronic wounds.Sci. Transl. Med.17,eadt0882(2025).DOI:10.1126/scitranslmed.adt0882

END
撰文 | 罗虎
审核 | 医工学人理事会
扫码添加医工学人负责人,进入综合及细分领域群聊(国内外医工交叉领域顶尖高校、科研院所、医院、企业等专家学者、硕博士、工程师、企业家等),参与线上线下交流活动

推荐阅读
点击关注医工学人
最新直播


本篇文章来源于微信公众号: 医工学人