星标“医工学人”,第一时间获取医工交叉领域新闻动态~


前言
/

调节迷走神经的生物电子疗法有望用于治疗心血管、炎症和精神疾病。然而,临床应用受到非特异性刺激引起的呼吸阻塞和头痛等副作用的限制。
为了设计选择性和功能性刺激,作者设计了 VaStim,一种高仿真且高性能的计算机模型。文章开发了一种通过简单的肌肉反应在体内进行个性化 VaStim 刺激的方案,通过将模型与对五头猪进行的试验相结合,成功重现了实验观察结果。通过优化的算法,VaStim 在几分钟内模拟了完整的纤维群,包括经常被忽略的无髓纤维,这些纤维占神经的 80%。该模型表明,神经上的所有 Aα 纤维都会影响喉肌,而心率变化是由特定束中的 B 传出神经引起的。它预测,与通常使用的方案相比,三极范式可以将喉部活动减少 70%。
VaStim 可以作为开发神经调节疗法的模型,通过最大限度地提高功效和特异性,减少动物实验。本研究由瑞士苏黎世联邦理工学院机器人与智能系统研究所健康科学与技术系神经工程实验室团队主导完成,详细内容于7月20日报道在了《自然·通讯》杂志。
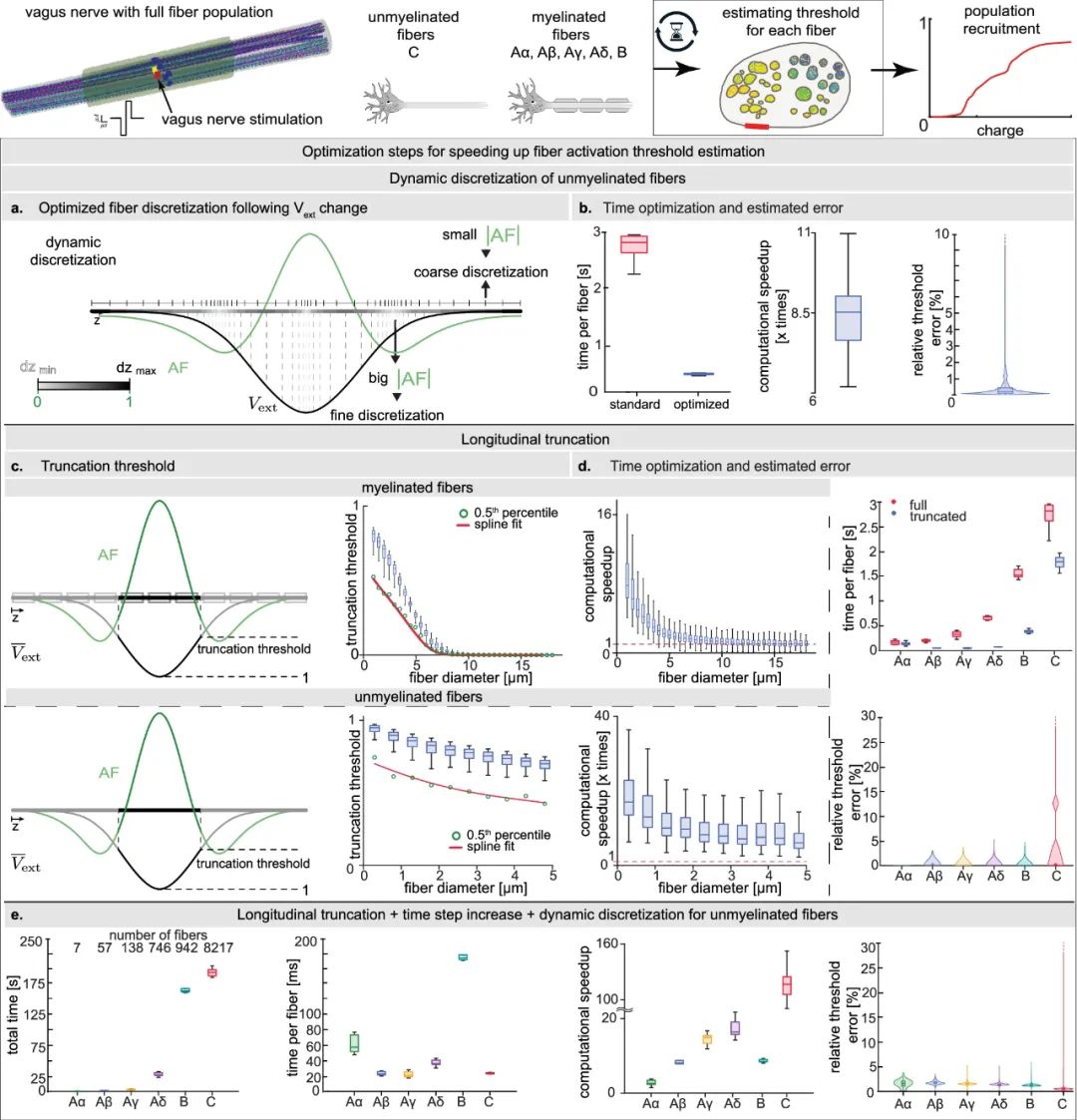
提高纤维活化阈值估计时间效率的优化方法
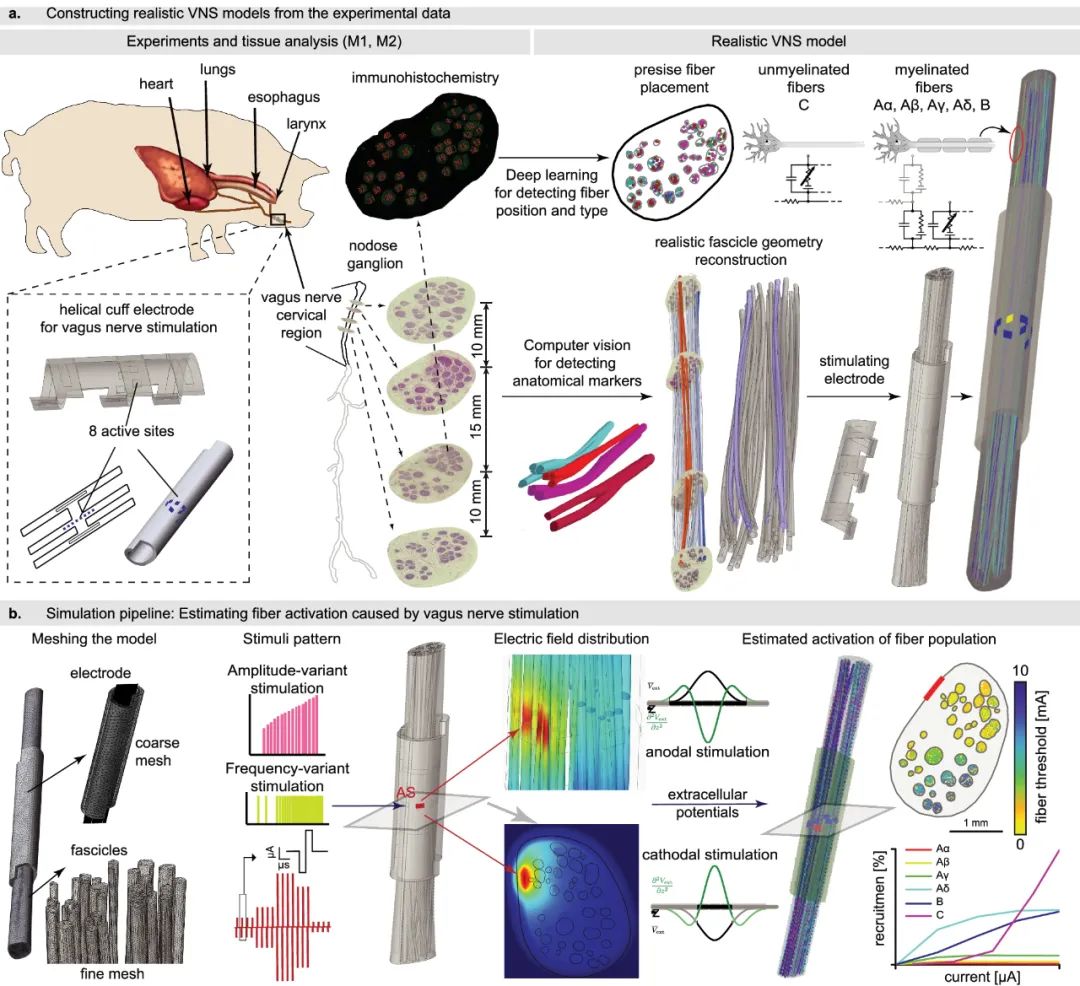
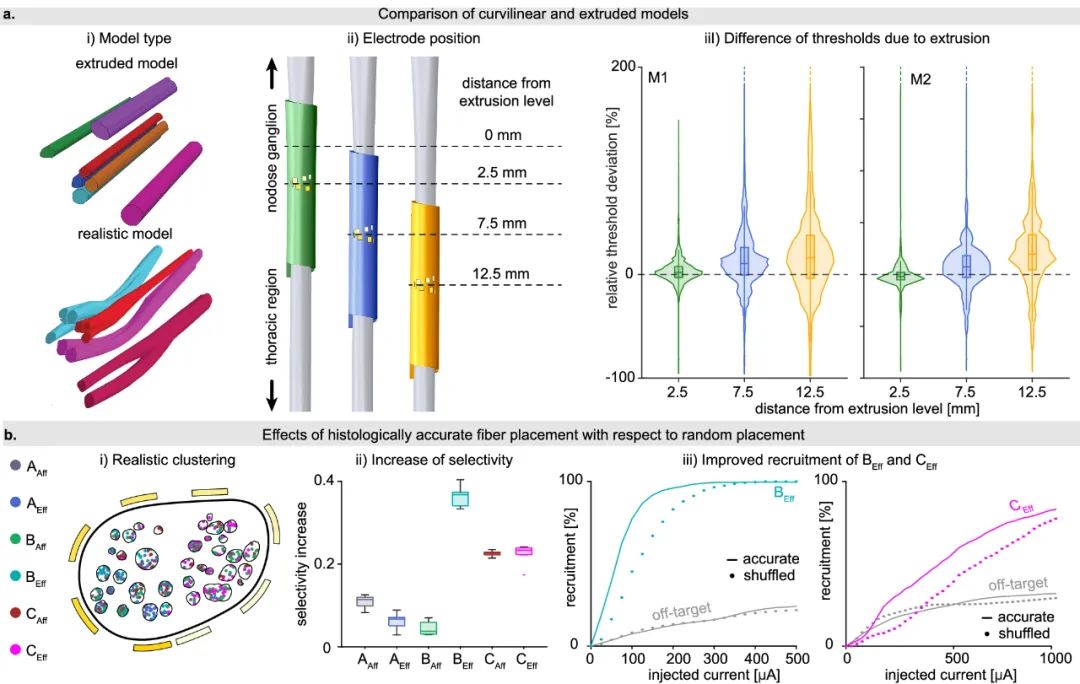
组织学和形态学上真实与简化的神经模型的比较
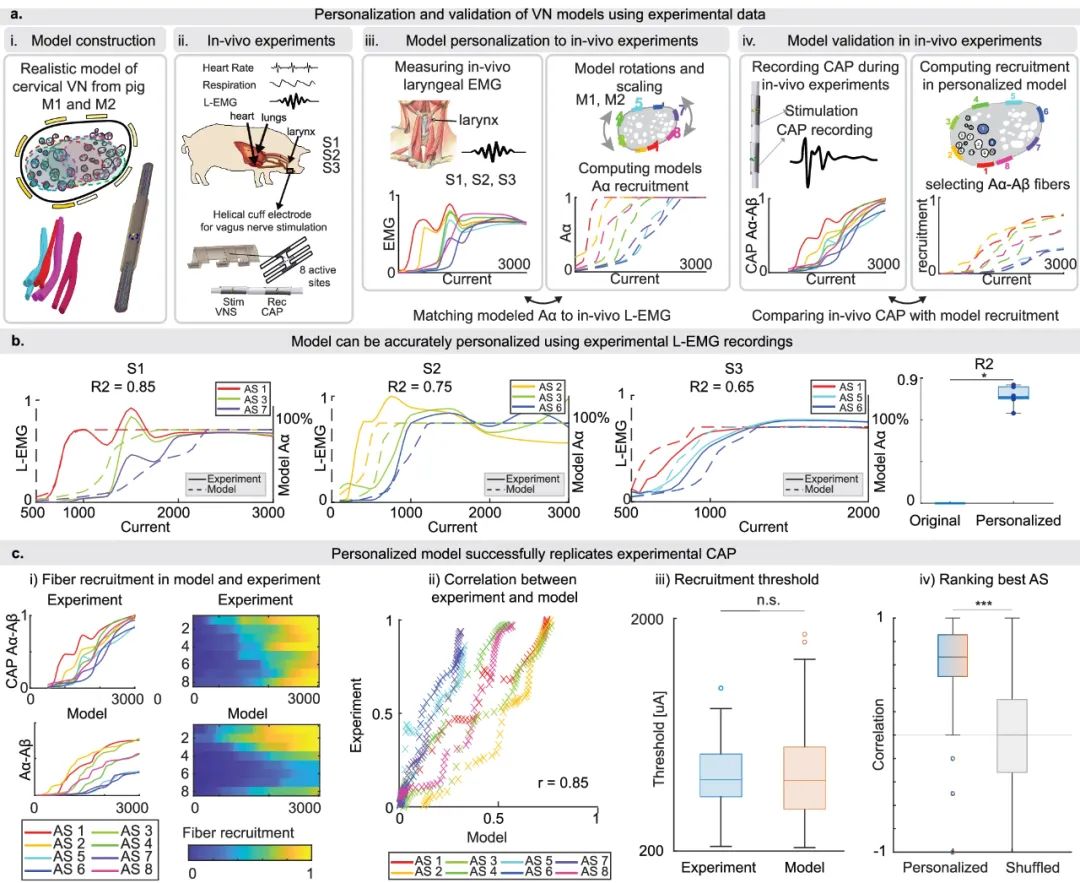
模型个性化和验证
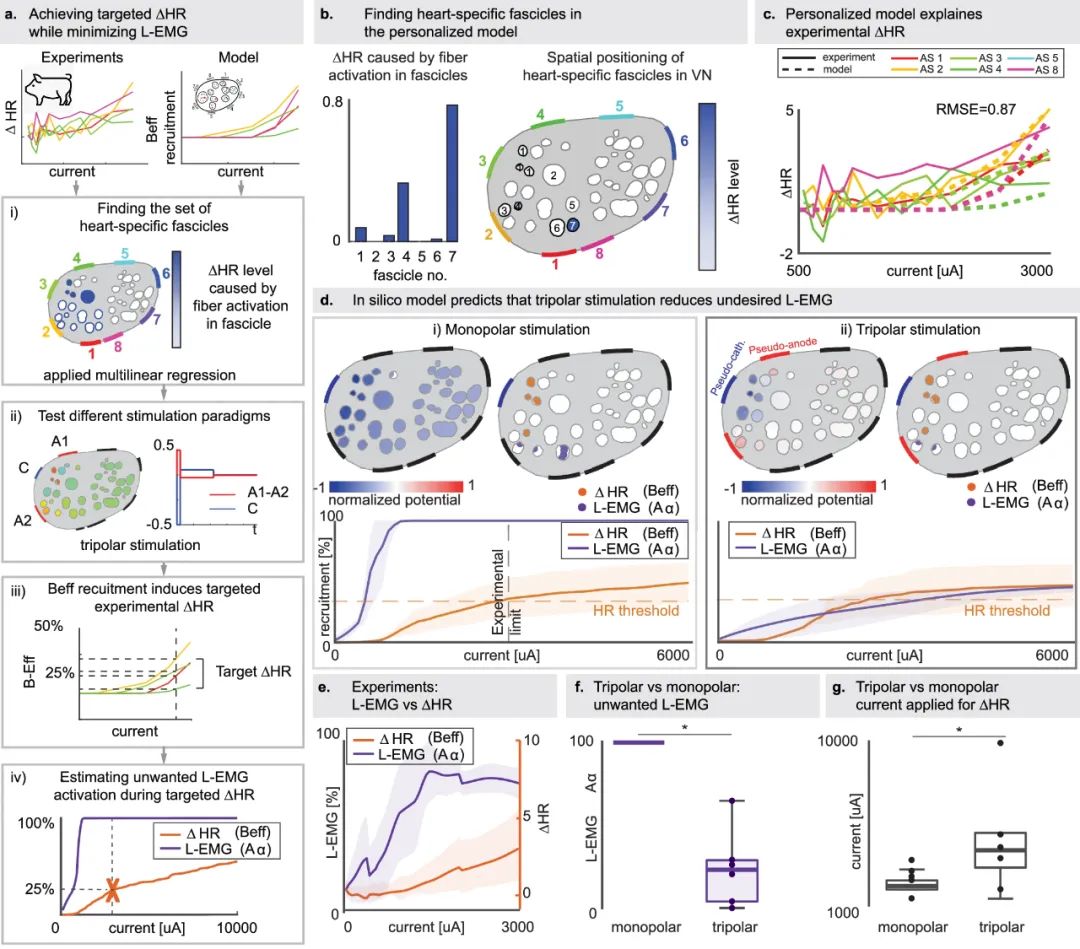
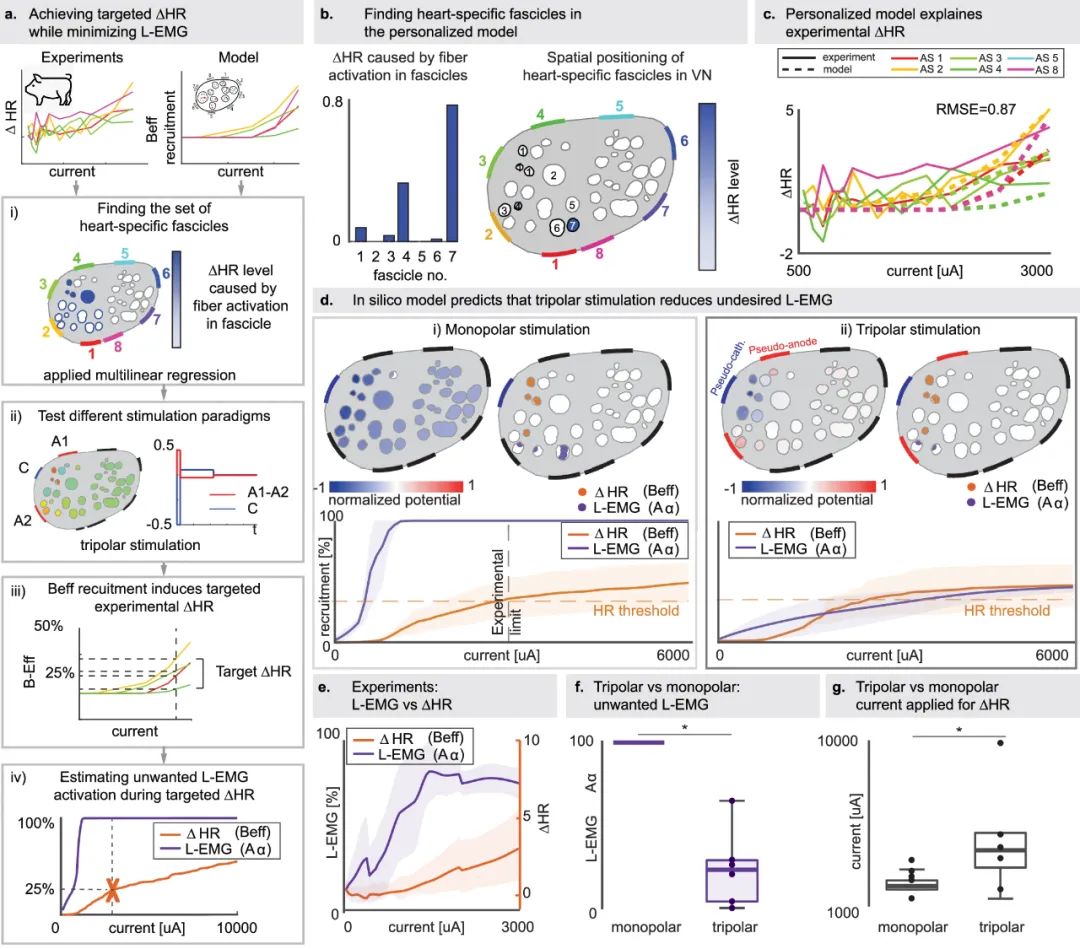
通过计算机模型解释实验心率变化并通过三极刺激提高选择性
精确的电极手术放置不会影响最大可实现的功能
结论
▼参考资料
Ciotti, F., John, R., Katic Secerovic, N. et al. Towards enhanced functionality of vagus neuroprostheses through in silico optimized stimulation. Nat Commun 15, 6119 (2024). https://doi.org/10.1038/s41467-024-50523-6.
*本文仅分享医疗科技前沿进展,不代表平台利益。如涉及版权问题,请联系我们删除。
END
编译 | 刘帅
来源 | Nature Communications
审核 | 医工学人
扫码注册加入医工学人,进入综合及细分领域群聊,参与线上线下交流活动

*声明:医工学人为公益性非盈利组织,不收取任何注册费用,注册申请通过后将以邮件通知
点击关注医工学人


本篇文章来源于微信公众号: 医工学人