基本信息
1 摘要
1 摘要
2 导读
-
心脏磁共振成像(CMR)的强大功能源于其对独特的广泛生理过程、图像对比度和组织状态的敏感性。这种灵活性使CMR能够可视化解剖结构、测量功能和流量,并利用核磁共振(NMR)弛豫等物理过程来揭示包括纤维化和炎症在内的组织状态。然而,虽然CMR可用于询问大量心脏组织/功能特征,但通常使用特定的CMR脉冲序列来收集这些特征中的每一个。例如,电影序列用于评估心脏运动和功能,微血管阻塞的对比增强灌注扫描,生存能力的晚期钆,浸润性疾病的T1标测,水肿的T2标测,铁过载的T2*标测等。这些序列中的大多数必须在屏息期间执行,以避免由于呼吸运动而产生的伪影,并且许多序列是门控的,以便仅在特定的心脏阶段收集数据。此外,传统的CMR采集收集心脏的3D结构内的2D平面,因此,如果正在评估整个心脏,则必须收集多个图像;这方面的一个常见示例是在电影成像中收集12-16个2D切片,以显示左心室从底部到顶部的运动。此外,某些序列的定时要求会使CMR协议进一步复杂化。例如,ECV标测和LGE成像需要在注射造影剂后的特定时间点进行成像;随后花费在等待形成适当对比度上的时间也会延长检查时间。 -
由于传统的CMR检查需要多个图像,每个图像具有不同的对比度,在不同的屏气中,在心脏的整个3D体积上,CMR协议可能会变得相当长;许多机构为每位患者安排45-60分钟的时间,即使是不合作的患者或解剖结构异常的患者,也可能经常超过这些时间。成功进行这一长系列扫描所需的费用和培训使CMR难以超越先进的学术医疗中心。这限制了高资源和低资源地区大部分人口的可及性。因此,公开需要用于CMR采集的快速方法,以减少单个图像和序列的采集时间,并且还减少整个协议的长度。 -
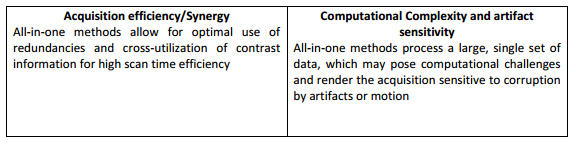
近年来,为了缩短CMR考试的时间,出现了几种不同的思想流派。一种基本方法是专门针对狭窄的临床问题定制方案,减少使用的单个序列的数量。例如,已经开发了一种构建良好的30分钟CMR检查,它可以解决大量的临床适应症。虽然这种方法在许多机构中使用,但研究人员正在设计新的技术,以更有效的方式收集所有对比。这些技术大致分为两类:“一体化”方法和“实时”方法。在“一体化”方法(也称为SMART CMR)中,新序列被设计为同时捕获多种形式的信息;在最极端的情况下,用于组织表征的运动场和图可以在单个综合采集中在心脏的整个体积上采集。在“实时”方法中,每个单独的序列被更快地收集,通常足够快,以消除屏息和心电图门控的需要,从而使整个协议更加高效。由于相关的技术挑战,这两种方法都尚未在临床上完全部署,但在每种新型方案的部分方面都取得了重大进展。 -
这份由两部分组成的手稿的目标是描述这两种不同类型的新兴快速CMR协议,即“一体化”和“实时”方法。为此,描述了每种方法的愿景,以及在临床实施过程中设计和测试的技术。介绍了不同方法的优缺点,并详细说明了每种方法的剩余开放需求。第1部分将介绍“一体化”方法,第2部分介绍“实时”方法,并对这些新兴方法进行总体总结。
3 “一体化” CMR
3.1“一体化”CMR协议的愿景

3.2“一体化”心脏成像的现有方法和验证
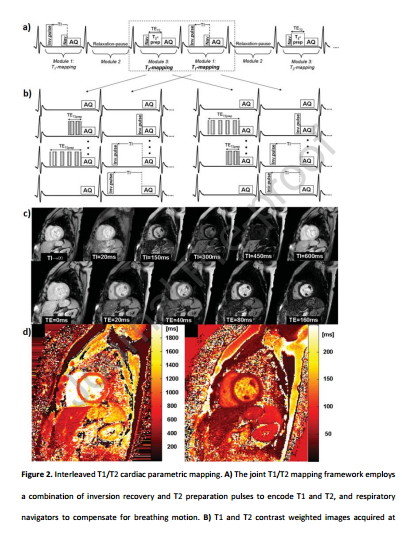
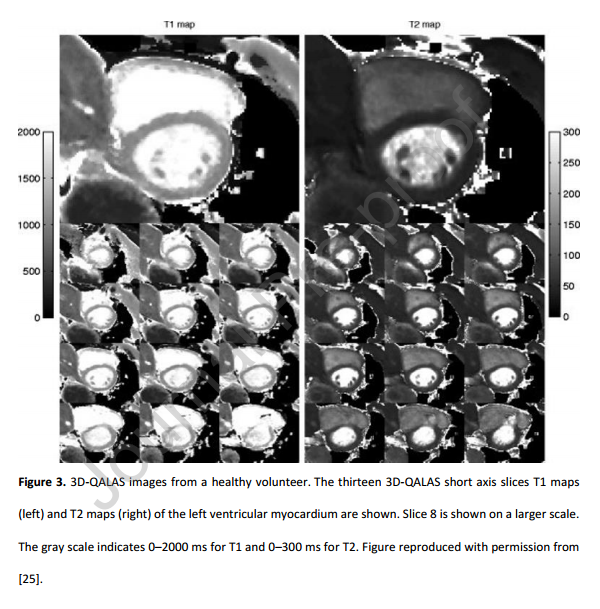
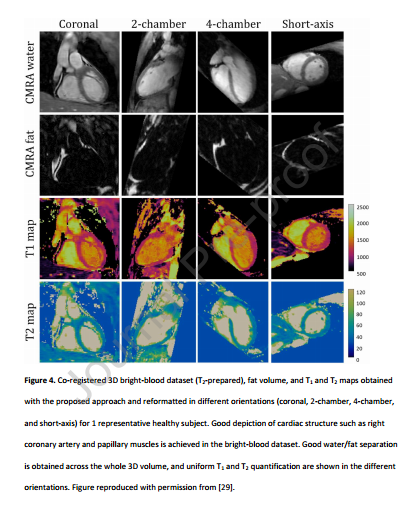
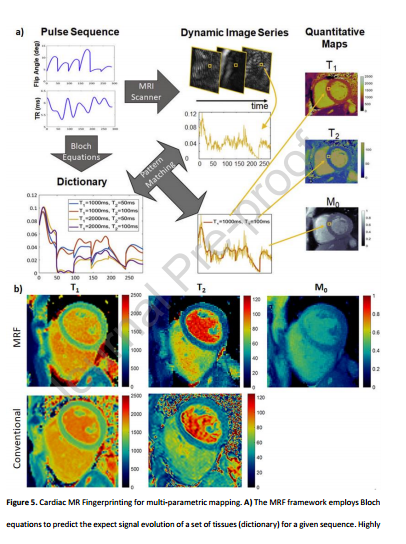
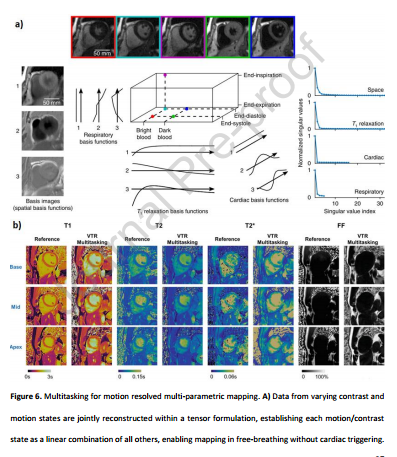
4 与传统CMR相比,一体化心脏检查的优点和缺点
4.1“一体化”CMR的优势
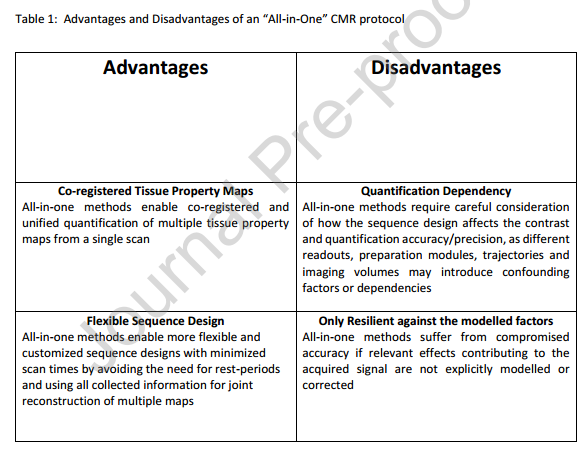
5 部署“一体化”协议之前的需求
5.1全面一体化开发
5.2临床验证和整合
5.3利用一体化协议的全部信息
6 第1部分结论

END
推荐阅读
点击关注医工学人

本篇文章来源于微信公众号: 医工学人